レンチウイルスのパッケージングにおいて力価が低いのはよくある問題で、プラスミド設計、細胞状態、トランスフェクション条件、収集および保存の各段階が影響します。
1. プラスミド・ベクター関連
-
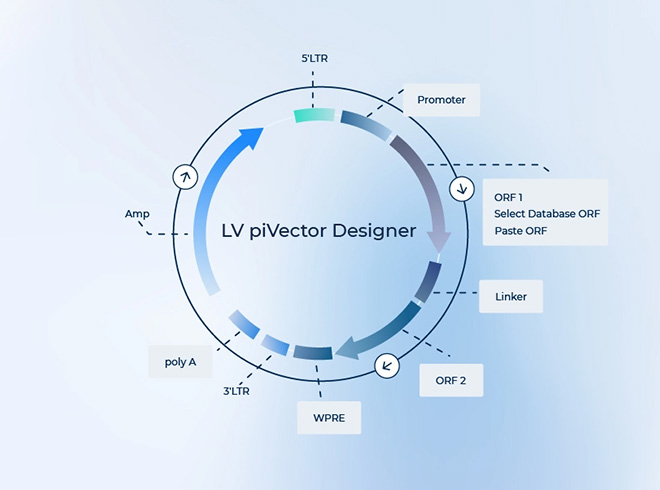
ベクター構築の問題:LTR、Ψ パッケージングシグナル、WPRE、cPPT などの必須エレメントが完全に含まれているか。不足や変異があると力価が大きく低下します。
-
プラスミドの純度:エンドトキシンや短い DNA 断片の混入は細胞の健康を損ない、産生効率を下げます。エンドトキシン除去型の精製を推奨。
-
プラスミドの比率:トランスファーベクター : パッケージングベクター : エンベロープベクターの比が不適切だと産生量が下がります。
2. 細胞の状態
-
細胞株の選択:293T が一般的ですが、研究室ごとの株で産生能に差があります。
-
細胞密度:トランスフェクション時に希薄すぎても過密すぎても力価低下。最適は 70–80% コンフルエンス。
-
細胞の健康:汚染、継代回数の多さ、コンディション不良はすぐに産生効率に影響。
3. トランスフェクション条件
-
トランスフェクション試薬と方法:PEI や Lipofectamine などの効果は条件によって大きく変わる。N/P 比や DNA:試薬比の最適化が必要。
-
DNA 総量:多すぎれば細胞死、少なすぎればウイルス産生不足。
4. 培養条件
-
培地:血清の有無や、ウイルス産生専用培地の使用有無。
-
回収タイミング:通常 48 時間と 72 時間で回収。早すぎても遅すぎても力価低下。
-
回収方法:回収後のフィルター処理や凍結融解の繰り返しで力価が落ちる。
5. 濃縮と保存
-
超遠心や限外濾過:濃縮しないと力価が低いまま、特にレンチウイルスは AAV ほど産生量が高くない。
-
保存条件:−20℃保存や凍結融解の繰り返しは急速に力価を落とす。−80℃保存が基本。
6. 力価測定方法
-
qPCR vs 機能的力価:qPCR で得られるゲノム力価は、実際の感染力価より高く出る傾向。
-
検定細胞株:標的細胞のレンチウイルス感受性によって結果が大きく変わる。
改善のヒント
-
プラスミド構築を再確認し、高純度・エンドトキシンフリーを使用。
-
健康な 293T 細胞を使い、最適密度でトランスフェクション。
-
トランスフェクション条件を最適化(DNA:試薬比など)。
-
48 h・72 h の上清を両方回収し、組み合わせて使用。
-
超遠心または限外濾過で濃縮。
-
力価検定方法を統一し、「見かけ上の低値」を回避。
PackGeneについて
PackGene Biotech is a world-leading CRO and CDMO, excelling in AAV vectors, mRNA, plasmid DNA, and lentiviral vector solutions. Our comprehensive offerings span from vector design and construction to AAV, lentivirus, and mRNA services. With a sharp focus on early-stage drug discovery, preclinical development, and cell and gene therapy trials, we deliver cost-effective, dependable, and scalable production solutions. Leveraging our groundbreaking π-alpha 293 AAV high-yield platform, we amplify AAV production by up to 10-fold, yielding up to 1e+17vg per batch to meet diverse commercial and clinical project needs. Moreover, our tailored mRNA and LNP products and services cater to every stage of drug and vaccine development, from research to GMP production, providing a seamless, end-to-end solution.