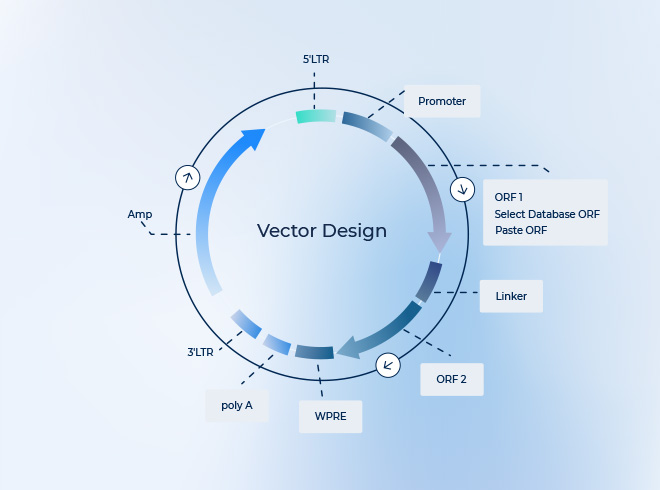
一、腺関連ウイルス(AAV)とは
腺関連ウイルス(Adeno-Associated Virus, AAV)は、小型でエンベロープを持たないウイルスで、パルボウイルス科に属します。1965年にアデノウイルス分離株の汚染物質から初めて発見されました。外観は二十面体構造を呈し、直径は約26 nm、カプシドタンパク質はVP1、VP2、VP3の3種類で構成されています。AAVのゲノムは一本鎖線状DNA(約4700 bp)で、上下流にそれぞれ145ヌクレオチドからなるITR(T字型末端反復配列)があり、その間にRepおよびCapの2つのオープンリーディングフレーム(ORF)が位置します。ITRはウイルスの複製起点およびパッケージングシグナルとして機能し、Rep遺伝子はウイルス複製とゲノムの組み込みに関与する複製タンパク質を、Cap遺伝子は3種のカプシドタンパク質をコードします。自然界に存在する天然型野生型AAVにはRepおよびCap遺伝子が含まれますが、実験用AAVベクターはこれを欠き、人工的に改変されたプラスミド形式であり、recombinant AAV(rAAV)と呼ばれます。特記がない場合、AAVはrAAVを指します。AAVには複数のセロタイプが存在し、ヒトおよびサルから12種類が分離されており、カプシドの構造や配列、組織特異性が異なるため、細胞受容体との相互認識にも差があり、感染効率や標的組織が異なります。AAVは宿主範囲が広く、安全性が高く、免疫原性が低く、発現安定性および物理的な安定性に優れるため、基礎研究や臨床試験で幅広く利用されており、世界で最も一般的な遺伝子治療ベクターの一つになっています。
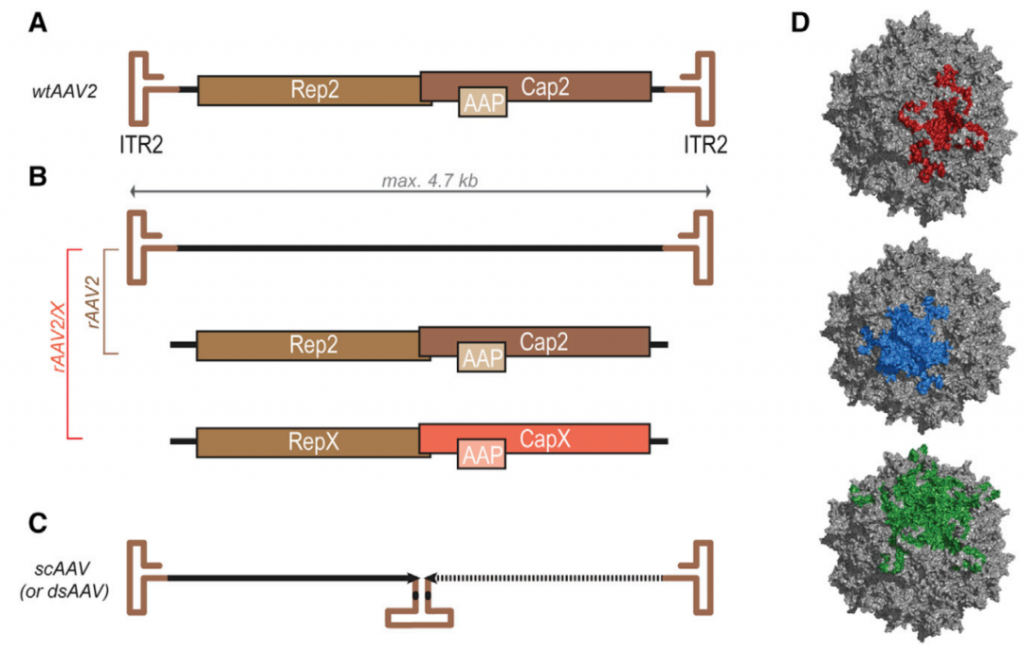
二、AAVのパッケージング
AAVは欠損型ウイルスであり、ヘルパーウイルス(アデノウイルスや単純ヘルペスウイルスなど)が存在しないと宿主細胞で複製/アセンブルできません。ヘルパーウイルスがない場合、AAVは宿主染色体の19番染色体上の特定部位(AAVS1)にゲノムを組み込み、ヘルパーウイルス出現まで潜伏状態を維持します。
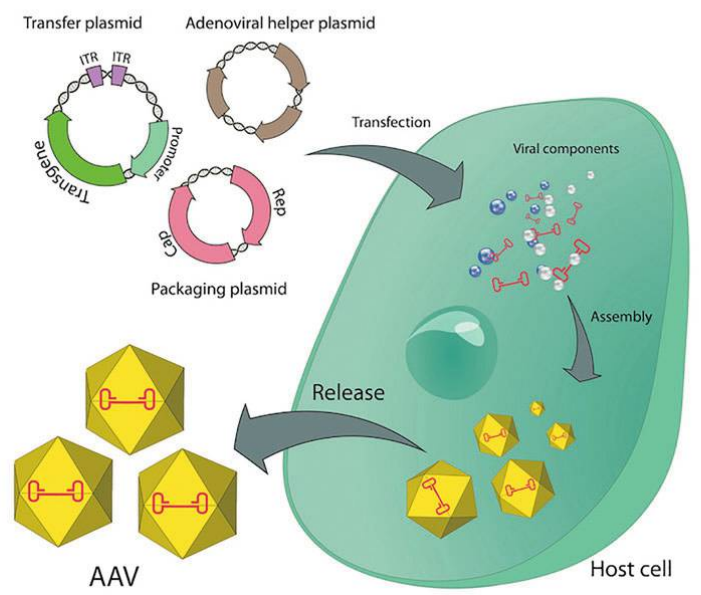
ヘルパーフリー(AAV Helper-Free System)では、ヘルパーウイルスを使用せずにrAAVを生産できます。この方式では、AAV複製と発現を調節するアデノウイルス遺伝子産物をプラスミドで宿主細胞に導入します。一般的には、外来遺伝子を含むベクタープラスミド、RepおよびCapをコードするアデノウイルス由来の補助プラスミド、およびRepおよびCap遺伝子を含むAAV複製プラスミドの三つを共トランスフェクトし、HEK293細胞に導入した後、細胞ライセートを超遠心精製して高力価ウイルスを得ます。
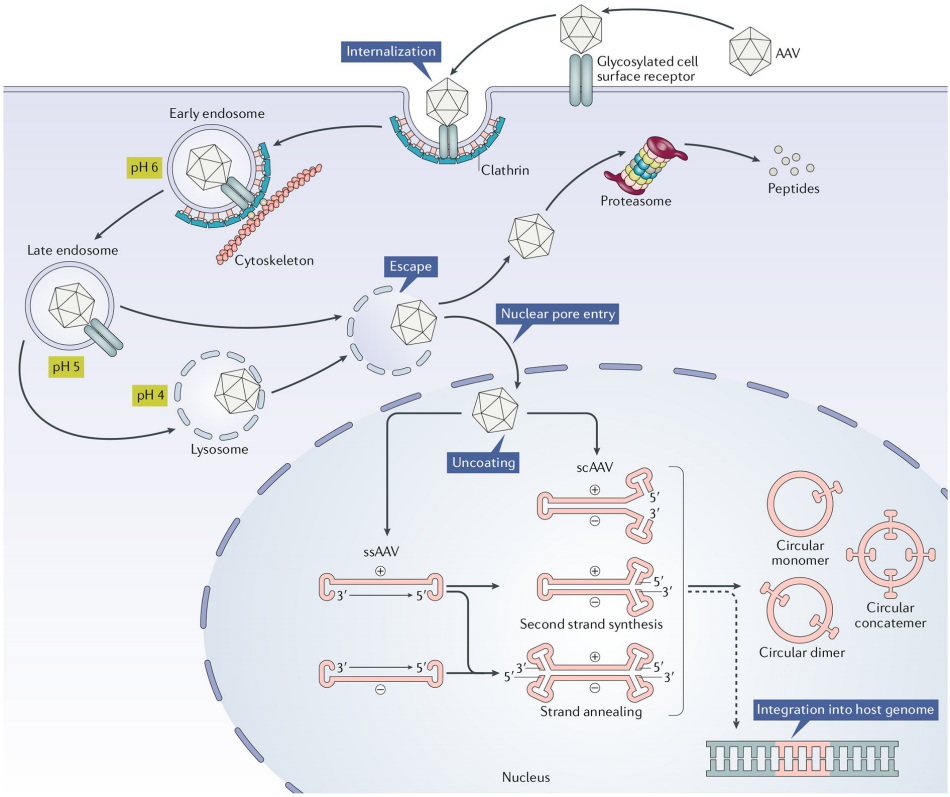
三、AAVパッケージングの実験手順
-
目的遺伝子の入手
-
AAVベクタープラスミドの構築およびシーケンシング:目的遺伝子をAAVベクターにクローン
-
ベクタープラスミド、ヘルパープラスミド、パッケージングプラスミドをHEK293細胞に共トランスフェクト
-
rAAV粗ウイルスの収集:遠心で細胞上清と沈殿を分離し、凍結融解を繰り返す
-
AAVウイルスの濃縮・精製:PEG8000による濃縮法/スクロース密度勾配超遠心法
-
AAVの品質検査:ウイルス力価、プラスミド残留、宿主DNA残留、BSA残留、マイコプラズマ、クラミジア、エンドトキシン、細菌・真菌の検出など
四、AAVパッケージングの利点と欠点
利点
-
安全性が高い:野生型AAVは人体への病原性が報告されておらず、rAAVではITR以外の遺伝子をプラスミドによって個別に提供するため、さらなる安全性が確保されています。
-
免疫原性が低い:AAV2は小さなゲノム(約4681ヌクレオチド)で、一般的なリコンビナントDNA技術で扱いやすく、動物実験における免疫反応が少ないため、感染後も免疫系による除去が少ないです。
-
宿主範囲が広い:哺乳動物への感染能力が高く、非分裂細胞も含めて人や非ヒトのタンパク質発現に成功しており、非常に汎用性があります。
-
多様な血清型:AAV1~AAV9およびDJ、DJ/8、Rh10など12種類。標的細胞や組織により適した選択が可能です。
-
発現の安定性・持続性が高い:宿主ゲノムへ整合せずに細胞核内でエピソームとして存在し、6か月以上持続発現が確認されています。
-
拡散性が高い:血液脳関門を通過可能であり、神経細胞やグリア細胞への感染にも適しています。
欠点
-
小さいベクター容量:挿入可能な外来DNAは最大で約3 kbと、レンチウイルスより制限があります。
-
体外での発現が低い:rAAVは一本鎖DNAであるため、体外で二本鎖に変換される効率が低く、実験用細胞では発現量が制限されます。複数の方法(Ad5型ヘルパーウイルスや高濃度の酪酸ナトリウムなど)で発現を増強できます。
-
発現速度が遅い:遅い発現タイミングが特徴で、通常、感染後2週間ほどで発現が観察されます(一本鎖DNAから二本鎖になるまでに時間を要するため)。
五、AAVパッケージングでよくある質問とその回答
1. 細胞実験より動物実験に適している理由は?
体外ではAAVの感染効率が低く、単鎖DNAの二本鎖への変換が遅く、細胞分裂によって感染が希薄化しやすいためです。一方、動物では組織標的が可能で、純化したウイルスを直接注入でき、免疫原性が低く、感染効率が高いため、豊富かつ持続的な発現が期待できます。
2. AAVの発現はどのくらい持続する?
AAVは環状二本鎖DNA(エピソーム)として存在し、神経など分裂しにくい細胞では1年以上、分裂する細胞でも3~6か月以上の持続発現が可能です。
3. AAVの主な応用例は?
-
遺伝子の過剰発現(CDSをAAVベクター経由で体内注入)
-
遺伝子干渉(shRNAをAAVベクターに組み込み)
-
遺伝子ノックアウト(sgRNAとCas9をAAVベクターで導入)
-
内因性過剰発現(sgRNAとdCas9を利用)
PackGeneについて
PackGene Biotech is a world-leading CRO and CDMO, excelling in AAV vectors, mRNA, plasmid DNA, and lentiviral vector solutions. Our comprehensive offerings span from vector design and construction to AAV, lentivirus, and mRNA services. With a sharp focus on early-stage drug discovery, preclinical development, and cell and gene therapy trials, we deliver cost-effective, dependable, and scalable production solutions. Leveraging our groundbreaking π-alpha 293 AAV high-yield platform, we amplify AAV production by up to 10-fold, yielding up to 1e+17vg per batch to meet diverse commercial and clinical project needs. Moreover, our tailored mRNA and LNP products and services cater to every stage of drug and vaccine development, from research to GMP production, providing a seamless, end-to-end solution.