Q1:AAV 三プラスミド包装システムとは何ですか?
AAV 三プラスミド包装システムは、現在最も一般的に使用されている AAV 製造方法です。
通常、HEK293 系細胞に以下の 3 種類のプラスミドを一過性導入することで AAV を産生します。
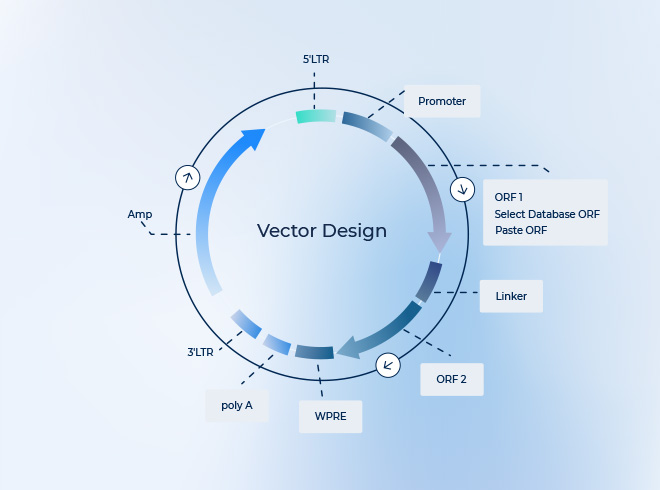
1.トランスファープラスミド
- ITR 配列および目的遺伝子発現カセットを含む
2. Rep/Cap プラスミド
- AAV の複製およびカプシド形成に必要
3. Helper プラスミド
- アデノウイルス由来の補助遺伝子(E2A、E4、VA RNA)を供給
Q2:三プラスミドの比率は AAV 収量に影響しますか?
はい。大きく影響します。
一般的な初期条件は 1:1:1(重量比) ですが、血清型やベクターデザインによって最適比率は異なります。
よく使用される最適化比率には以下があります。
-
1 : 1 : 2
-
1 : 2 : 1
-
1 : 1.5 : 1.5
不適切な比率は、収量低下や空カプシド率の増加を引き起こす可能性があります。
Q3:トランスファープラスミドのサイズは包装効率に影響しますか?
はい。AAV はゲノムサイズに非常に敏感です。
ITR を含む全長は 4.7 kb 以下を推奨
サイズ超過の場合:
- 包装効率の低下
- 不完全ゲノムの増加
- 発現の不安定化
Q4:強力なプロモーターほど AAV 収量は高くなりますか?
必ずしもそうではありません。
強力なプロモーター(例:CMV)は、
細胞毒性を引き起こし、結果的に AAV 収量が低下する場合があります。
中程度または組織特異的プロモーターの使用により、
より高い実用的ウイルス収量が得られることがあります。
Q5:GFP 蛍光が強い=AAV 滴度が高い、ですか?
いいえ。
-
GFP 蛍光は転写・発現の指標に過ぎません
-
AAV 粒子数や機能的滴度を直接反映しません
AAV 滴度は qPCR、ddPCR、ELISA などで評価する必要があります。
Q6:トランスフェクション条件は重要ですか?
非常に重要です。
主な影響因子:
-
細胞の状態(70–80% コンフルエンシー、マイコプラズマ陰性)
-
トランスフェクション試薬(PEI 等)
-
DNA:試薬比率
-
トランスフェクション後の培養条件
Q7:AAV の最適な回収時間は?
一般的には トランスフェクション後 48–72 時間 です。
血清型や条件により、72 時間で収量が向上する場合もあります。
Q8:高滴度なのに転導効率が低いのはなぜですか?
考えられる原因:
-
空カプシド率が高い
-
ゲノム不完全
-
実際の機能的滴度が低い
-
血清型が標的細胞に適していない
Q9:三プラスミド包装の最適化で空カプシドを減らせますか?
可能です。
-
プラスミド比率の最適化
-
トランスフェクション条件の改善
-
ゲノムサイズの適正化
は空カプシド低減に有効です。
Q10:自社での AAV 包装が安定しない場合はどうすればよいですか?
AAV 三プラスミド包装は、
プラスミド設計、比率、トランスフェクション条件、培養・回収工程など
多数の要因が結果に影響する高度なプロセスです。
再現性の確保や安定した品質が難しい場合は、
AAV 包装に特化した専門サービスの利用をおすすめします。
当社では:
-
血清型別に最適化された三プラスミド包装条件
-
高い再現性を実現する標準化プロセス
-
厳格な品質管理および滴度評価
-
研究用途から前臨床用途まで対応可能な AAV 製造体制
を提供し、安定した高品質 AAV の供給をサポートしています。
PackGeneについて
PackGene Biotech is a world-leading CRO and CDMO, excelling in AAV vectors, mRNA, plasmid DNA, and lentiviral vector solutions. Our comprehensive offerings span from vector design and construction to AAV, lentivirus, and mRNA services. With a sharp focus on early-stage drug discovery, preclinical development, and cell and gene therapy trials, we deliver cost-effective, dependable, and scalable production solutions. Leveraging our groundbreaking π-alpha 293 AAV high-yield platform, we amplify AAV production by up to 10-fold, yielding up to 1e+17vg per batch to meet diverse commercial and clinical project needs. Moreover, our tailored mRNA and LNP products and services cater to every stage of drug and vaccine development, from research to GMP production, providing a seamless, end-to-end solution.