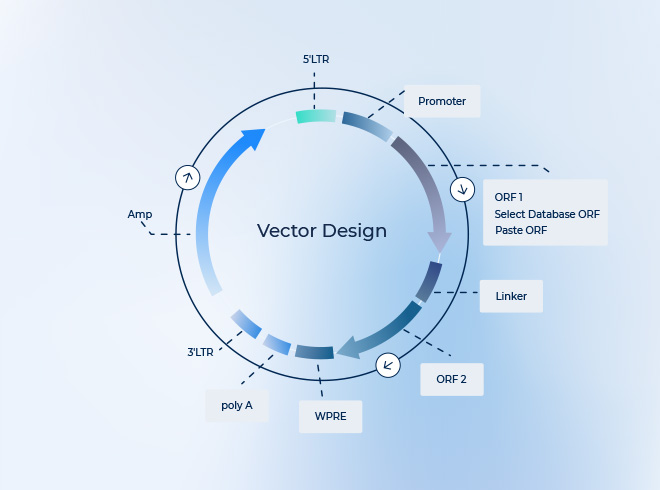
AAV(アデノ随伴ウイルス)は遺伝子治療でよく用いられるベクターですが、天然型セロタイプが持つ tropism(組織/細胞嗜好性) には限界があります。標的化(特定の細胞や組織への感染精度)を高めるには、主に パッケージング戦略やカプシド工学 が利用されます。
1. 適切なセロタイプやキメラセロタイプの選択
-
天然セロタイプの選択 例:
-
AAV9 → 心臓、神経系
-
AAV8 → 肝臓
-
AAV6 → 筋肉、呼吸器
-
-
キメラセロタイプ(例:AAV-DJ, AAV-LK03):複数セロタイプのカプシド遺伝子を組み合わせ、新しいtropismを持つ変異体を得る。
2. カプシドタンパク質の改変(Capsid engineering)
-
点変異(rational design):VP1/VP2/VP3の特定アミノ酸を改変し、天然受容体との結合を減らす/新しい受容体親和性を強化。
-
ペプチド挿入(peptide insertion):カプシド表面ループに短いペプチドや受容体結合モチーフ(例:RGD)を挿入して標的細胞特異性を付与。
-
指向性進化(directed evolution):ランダム変異ライブラリを標的細胞や動物モデルでスクリーニングし、高効率な感染能を持つ変異体を選抜。
3. 偽型化(Pseudotyping)
-
ゲノムは固定(通常AAV2 ITR) しつつ、外殻カプシドを別セロタイプに置換 → AAV2の複製特性を維持しつつ、新しいtropismを獲得。
4. 特定プロモーターや調節因子の利用(転写レベルでの標的化)
-
ウイルスが非標的細胞に侵入しても、組織特異的プロモーター(例:GFAP → アストロサイト、cTnT → 心筋細胞)で転写を制御可能。
-
miRNA標的配列:転写産物の3’UTRに組み込み、非標的細胞ではmiRNAによるサイレンシングが働く。
5. 非特異的結合の抑制(オフターゲット低減)
-
化学修飾(PEG化など)で非標的組織との結合を抑制。
-
天然受容体(例:AAV2のヘパラン硫酸プロテオグリカン)との親和性を低下させ、目的受容体結合を優先させる。
6. 併用投与戦略
-
抗体やアプタマーをAAV表面に結合させ、標的細胞へ誘導。
-
組織特異的ペプチドとの融合により、臓器への送達効率を向上。
AAVの標的化最適化は、カプシド改変(物理的アプローチ) と 転写制御(機能的アプローチ) を組み合わせることで実現されます。臨床的には 指向性進化で得られた変異体 と 組織特異的プロモーター が最も有効な戦略です。
PackGeneについて
PackGene Biotech is a world-leading CRO and CDMO, excelling in AAV vectors, mRNA, plasmid DNA, and lentiviral vector solutions. Our comprehensive offerings span from vector design and construction to AAV, lentivirus, and mRNA services. With a sharp focus on early-stage drug discovery, preclinical development, and cell and gene therapy trials, we deliver cost-effective, dependable, and scalable production solutions. Leveraging our groundbreaking π-alpha 293 AAV high-yield platform, we amplify AAV production by up to 10-fold, yielding up to 1e+17vg per batch to meet diverse commercial and clinical project needs. Moreover, our tailored mRNA and LNP products and services cater to every stage of drug and vaccine development, from research to GMP production, providing a seamless, end-to-end solution.