1. パッケージング効率が低い
原因:
- トランスフェクション効率が低い(HEK293などのパッケージ細胞で効率不足)
- プラスミドの比率が不適切(ベクタープラスミド、アシストプラスミド、パッケージングプラスミドの比率が間違っている)
- 細胞状態が不良(細胞が過密または過疎、または健康状態が悪い)
解決策:
- 細胞の状態や密度を最適化
- 三元プラスミドまたは四元プラスミドの比率を調整
- 高効率のトランスフェクション試薬を使用
2. ウイルス滴度が低い
原因:
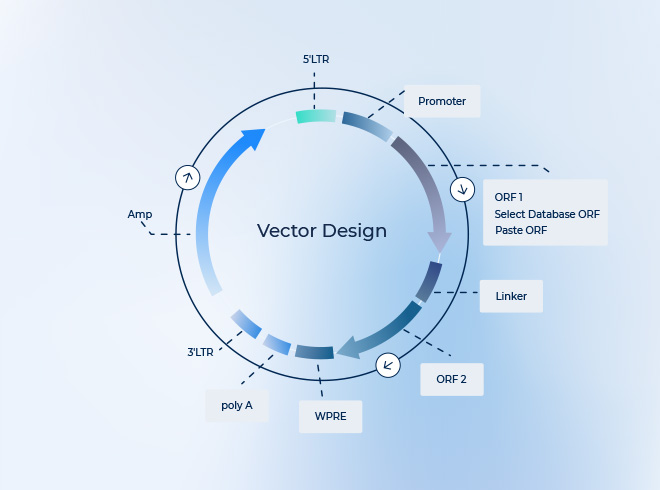
- ベクターゲノムが大きすぎる(AAVの有効容量は約4.7〜5 kb)
- プラスミドの損傷や変異
- トランスフェクション条件が不適切
解決策:
- ベクターサイズを制限し、5 kb以下にする
- プラスミド配列の完全性を確認
- 培養および収穫条件を最適化
3. ウイルスの純度が低い
原因:
- 宿主細胞タンパク質やDNA、エンドトキシンの残留
- 粒子組立不完全による空カプシドの存在
解決策:
- 密度勾配遠心(CsCl、OptiPrep)またはカラムクロマトグラフィーによる精製
- 厳密な品質管理検査(SDS-PAGE、qPCR、ELISA)を実施
4. 蛍光またはレポータージーンの発現が弱い
原因:
- プロモーターが目的細胞に適していない
- 感染効率が低い
- ウイルス滴度が不足
解決策:
- より強力または細胞特異的なプロモーターに変更
- ウイルス感染量を増やす、感染方法を改善
- 高滴度ウイルスを使用
5. AAVの安定性が低い
原因:
- 凍結融解の繰り返し
- 保存温度が不適切
解決策:
- 凍結融解を避け、分注保存
- 長期保存は-80℃、短期は液体窒素で保存
- 適切なバッファーを使用(例:PBS + 0.001% Pluronic F68)
6. エンドトキシンや汚染の問題
原因:
- 細胞培養または精製過程での不衛生
- プラスミド準備でのエンドトキシン存在
解決策:
- 無菌操作および低エンドトキシンプラスミドを使用
- 厳格な品質管理、エンドトキシンレベルの測定
💡 まとめ:
AAVパッケージングで重要なのは 細胞状態、プラスミド品質、トランスフェクション条件、精製方法、保存条件 です。ほとんどの問題はこれらの条件を最適化することで解決可能です。
PackGeneについて
PackGene Biotech is a world-leading CRO and CDMO, excelling in AAV vectors, mRNA, plasmid DNA, and lentiviral vector solutions. Our comprehensive offerings span from vector design and construction to AAV, lentivirus, and mRNA services. With a sharp focus on early-stage drug discovery, preclinical development, and cell and gene therapy trials, we deliver cost-effective, dependable, and scalable production solutions. Leveraging our groundbreaking π-alpha 293 AAV high-yield platform, we amplify AAV production by up to 10-fold, yielding up to 1e+17vg per batch to meet diverse commercial and clinical project needs. Moreover, our tailored mRNA and LNP products and services cater to every stage of drug and vaccine development, from research to GMP production, providing a seamless, end-to-end solution.