Q1. AAVパッケージングがうまくいかない主な原因は何ですか?
A. 主な原因として、以下が挙げられます。
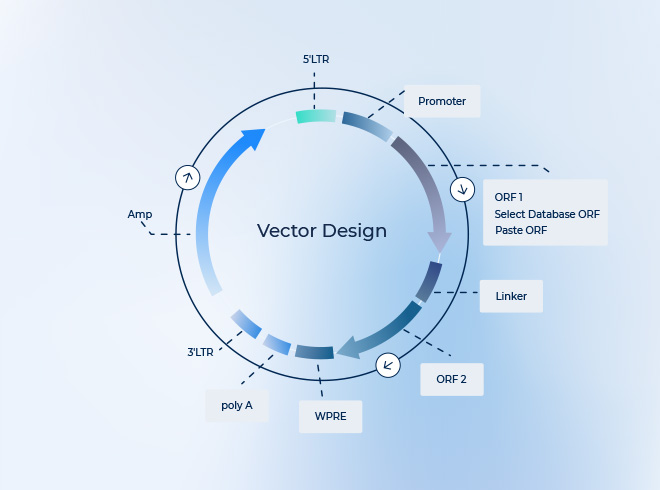
- 挿入遺伝子サイズが大きすぎる(一般にITR間で約4.7 kb以内が推奨)
- 強毒性/細胞毒性の高い遺伝子による宿主細胞への負担
- プロモーターやエンハンサーの不適切な選択
- rep/capプラスミドやヘルパープラスミドの品質不良
- トランスフェクション条件(DNA量、比率、試薬、細胞状態)の最適化不足
Q2. AAVの力価(タイター)が低いのはなぜですか?
A. 力価低下の要因として、以下が考えられます。
- トランスフェクション効率が低い
- ウイルス回収時の操作ロス(回収タイミング、凍結融解条件など)
- 精製工程でのロスや不適切な精製方法
- 空殻ウイルス(empty capsid)の割合が高い
- 保存条件(温度、凍結融解回数)が不適切
Q3. 空殻ウイルスの割合が高くなる原因は?
A. 主な原因は以下の通りです。
- ゲノムサイズが小さすぎる、またはパッケージング効率が低い配列設計
- rep/capとベクタープラスミドの比率不適切
- パッケージング細胞の状態不良
- 精製方法(密度勾配超遠心など)の最適化不足
Q4. AAV感染後に遺伝子発現が見られない/低いのはなぜですか?
A. 以下の点を確認してください。
- 標的細胞/組織に適した血清型(セロタイプ)を使用しているか
- プロモーターが標的細胞で活性を持つか
- MOI(感染多重度)が十分か
- 発現確認までの培養・観察期間が適切か
- レポーター遺伝子やタグ配列の設計に問題がないか
Q5. in vivo実験にAAVがよく使われる理由は何ですか?
A. AAVは以下の利点を持つため、in vivo実験に適しています。
- 免疫原性が比較的低い
- 長期発現が可能
- 非分裂細胞(神経細胞など)にも高効率で感染可能
- 多様な血清型により組織指向性を選択できる
Q6. AAVの保存条件は?
A. 一般的には以下が推奨されます。
- 短期保存:4°C(数日〜1週間程度)
- 長期保存:-80°C
- 凍結融解は極力避け、アリコート分注を推奨
Q7. 科研用途のAAVをそのまま臨床研究に使用できますか?
A. 通常、使用できません。臨床用途ではGMP準拠製造、厳格な品質管理(無菌、エンドトキシン、完全配列確認など)が必須です。科研グレードAAVは研究目的に限定して使用してください。
Q8. AAVパッケージングを外注する際の注意点は?
A. 以下の点を確認することをおすすめします。
- 対応可能な血清型・プロモーターの種類
- 実績と品質管理体制
- 力価測定方法(qPCR、ddPCR、ELISAなど)
- 納期、技術サポートの有無
PackGeneについて
PackGene Biotech is a world-leading CRO and CDMO, excelling in AAV vectors, mRNA, plasmid DNA, and lentiviral vector solutions. Our comprehensive offerings span from vector design and construction to AAV, lentivirus, and mRNA services. With a sharp focus on early-stage drug discovery, preclinical development, and cell and gene therapy trials, we deliver cost-effective, dependable, and scalable production solutions. Leveraging our groundbreaking π-alpha 293 AAV high-yield platform, we amplify AAV production by up to 10-fold, yielding up to 1e+17vg per batch to meet diverse commercial and clinical project needs. Moreover, our tailored mRNA and LNP products and services cater to every stage of drug and vaccine development, from research to GMP production, providing a seamless, end-to-end solution.