本ページでは、研究者の皆様からよく寄せられる
AAV/レンチウイルスベクター作製に関する質問と解決策をまとめています。
Q1:ウイルス力価が低い原因は何ですか?
主な原因
-
プラスミドDNAの純度不足(エンドトキシン高値)
-
トランスフェクション効率の低下
-
遺伝子サイズがパッケージング容量を超過
-
細胞状態不良(密度・生存率)
解決策
-
高純度・低エンドトキシンのプラスミドを使用
-
トランスフェクション条件の最適化
-
遺伝子サイズの管理
-
AAV:4.7 kb 以下(ITR 含む)
-
レンチウイルス:8–9 kb 以下
-
-
対数増殖期・生存率90%以上の細胞を使用
Q2:感染後に発現しない、または発現が低いのはなぜですか?
主な原因
-
プロモーターが標的細胞に適していない
-
AAV 血清型の選択ミス
-
MOI が低すぎる
-
遺伝子自体の発現制限または毒性
解決策
-
細胞種に適したプロモーターを選択(CMV、EF1α、CAG など)
-
組織・動物種に応じた AAV 血清型を選択
-
MOI の段階的検討
-
GFP や FLAG などのタグによる確認
Q3:感染後に細胞死が多く発生します
主な原因
-
ウイルス量が過剰
-
遺伝子毒性
-
感染条件が過剰
解決策
-
MOI を下げる、分割感染
-
誘導発現系(Tet-On)の使用
-
感染時間の短縮
-
感受性の高い細胞にはレンチウイルスを推奨
Q4:AAV の空カプシド比率が高い場合、問題になりますか?
説明
空カプシドは遺伝子を含まないため、有効感染効率を低下させます。
対策
-
三種プラスミド比率の最適化
-
ITR 配列の完全性確認
-
密度勾配遠心やクロマトグラフィーによる精製
-
成熟した製造プロセスを持つサービスの利用
Q5:ウイルスの保存方法を教えてください
-
-80℃ で長期保存
-
小分け保存し、凍結融解を繰り返さない
-
使用時は 37℃ で迅速解凍後、直ちに氷上保持
Q6:ウイルス力価測定値が異なるのはなぜですか?
理由
-
測定方法の違い
-
AAV:vg/mL(qPCR)
-
レンチウイルス:TU/mL、IFU/mL
-
推奨
-
同一プロジェクト内で測定方法を統一
-
COA(解析報告書)の確認
Q7:ウイルス実験の成功率を高めるには?
-
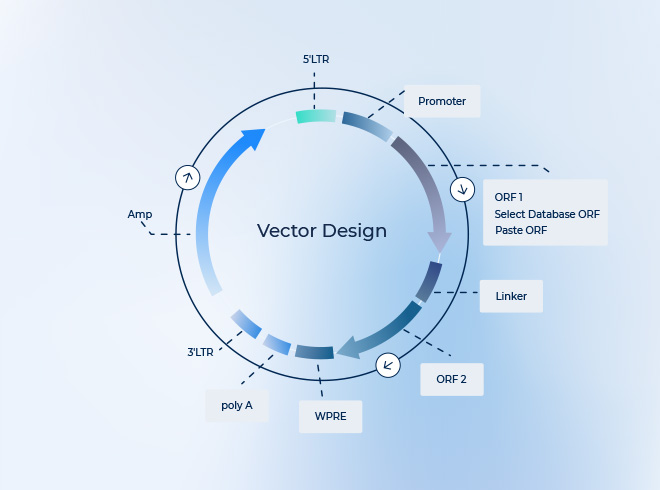
適切なベクター設計
-
安定した製造プロセス
-
高品質ウイルスの使用
PackGeneについて
PackGene Biotech is a world-leading CRO and CDMO, excelling in AAV vectors, mRNA, plasmid DNA, and lentiviral vector solutions. Our comprehensive offerings span from vector design and construction to AAV, lentivirus, and mRNA services. With a sharp focus on early-stage drug discovery, preclinical development, and cell and gene therapy trials, we deliver cost-effective, dependable, and scalable production solutions. Leveraging our groundbreaking π-alpha 293 AAV high-yield platform, we amplify AAV production by up to 10-fold, yielding up to 1e+17vg per batch to meet diverse commercial and clinical project needs. Moreover, our tailored mRNA and LNP products and services cater to every stage of drug and vaccine development, from research to GMP production, providing a seamless, end-to-end solution.