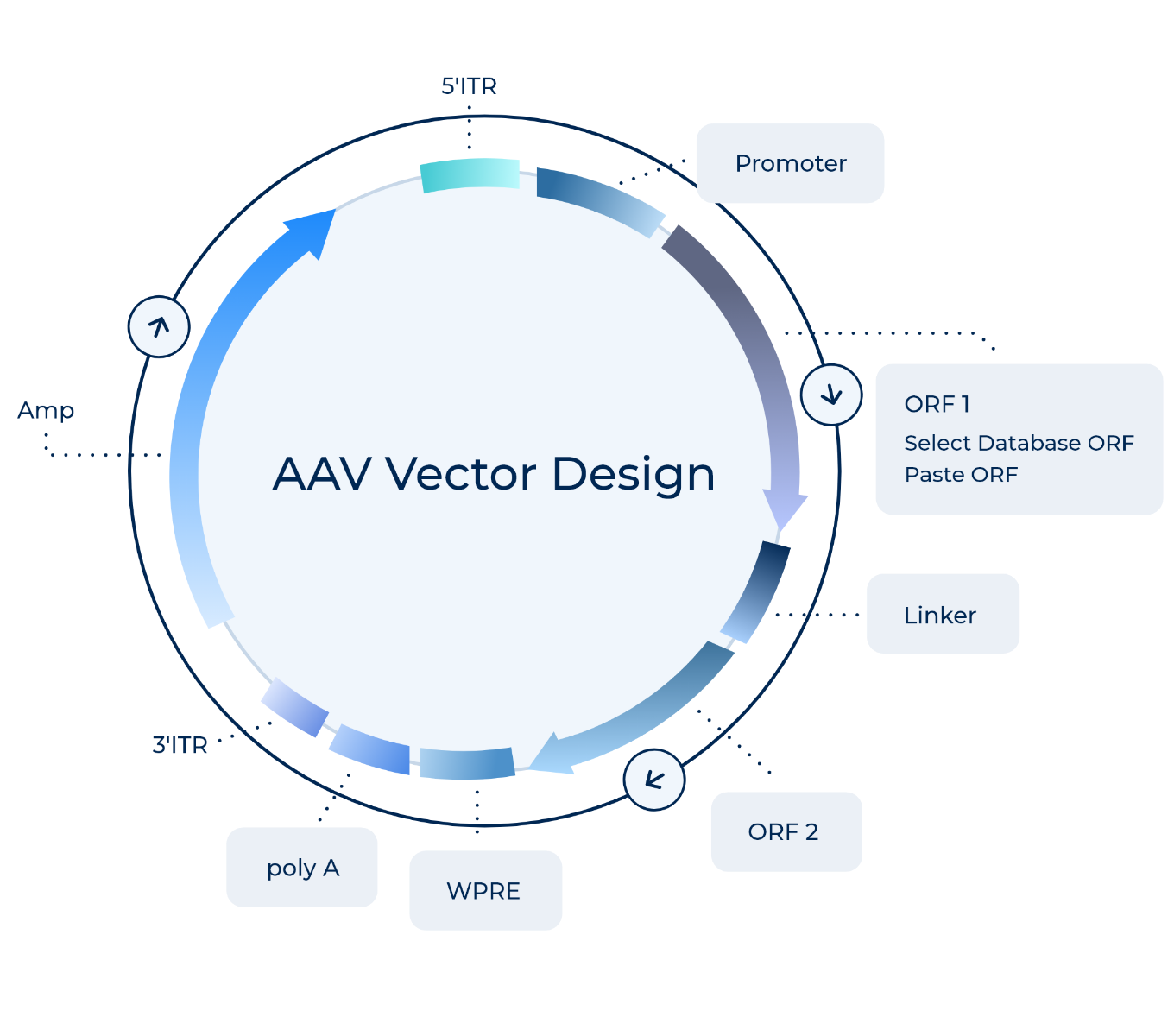
PackGene 独自の AAV Cas9 発現ベクターは、単一ベクターから SpCas9 または SaCas9、sgRNA、あるいは Cas9 と sgRNA の両方を共発現するように丁寧に設計されています。
piVector Designer で利用可能
- SpCas9 デュアルベクターまたはオールインワンベクター
PackGene 独自の SpCas9 遺伝子発現ベクターは、単一の AAV ベクター内で SpCas9 と sgRNA を共発現するように操作されています。SpCas9 発現配列が AAV の挿入長制限(~5kb)内に収まるようにするため、我々はコンパクトで効率的なプロモーター配列である EF1α または miniCMV を sgRNA 発現に使用します。この戦略により、我々は sgRNA 発現カセットの全長を短縮するための MS2-P65-HSF1 を用いた単一の AAV CRISPR ベクターを作製しました。この方法により、信頼性が高く効率的な SpCas9 と sgRNA の共発現が可能になり、混合細胞発現表現型のリスクや一貫性のない、あるいは偽のデータの可能性を最小限に抑えます。
- SaCas9 デュアルベクターまたはオールインワンベクター
SaCas9 は、SpCas9 と比較して約 3.2kb というより短い遺伝子にコードされているものの、SpCas9 と同様の切断活性を維持する短縮型バージョンです。加えて、SaCas9 の PAM 配列である NNGRRT は、宿主ゲノム中で約 32bp ごとに 1 回という低頻度で発生し、21-23nt の標的配列は伝統的な SpCas9 の標的配列長である~20nt と比較してより長いです。これらの NNGRRT の低頻度発生と拡張された標的配列長が SaCas9 のより高い結合特異性に寄与し、理論的には伝統的な SpCas9 と比較してオフターゲット切断率が低くなります。
ご要望があれば、当社の技術サポートチームまでお問い合わせください。
- SpCas9HF
SpCas9 の高忠実度バージョン
- SaCas9HF
SaCas9 の高忠実度バージョン
- AAV-CRISPR 遺伝子活性化 MS2-P65-HSF1
SpCas9 は、従来、標的遺伝子ノックアウトを生み出すために sgRNA とペアリングされますが、改変された MS2 RNA リンカーを含む sgRNA ともペアリングすることができます。改変された MS2 構成では、SpCas9 は DNA 切断能を失い、代わりに MS2-P65-HSF1 転写活性化複合体を動員し、それによって下流の遺伝子転写を促進します。このアプローチにより転写活性化が可能になり、内在性遺伝子発現を 1000 倍以上増加させる可能性があります。
- NmCas9
約 3.3kb の NmCas9 は、SpCas9 と同様の活性を持つ Cas9 の代替バージョンであり、極めて低いオフターゲット切断率が要求される用途において利点をもたらします。NmCas9 は、SpCas9 の PAM(プロトスペーサー隣接モチーフ)が約 128 塩基対ごとに 1 回程度発生するのに対し、より低頻度で発生するより長い PAM 配列(NNNNGATT)を認識し、それにより標的特異性が高まります。これらの特性は、NmCas9 が他の Cas バリアントと比較して理論的に低いオフターゲット切断率をもたらし、それにより非常に精密なゲノム編集用途に最適なものとしています。
- AsCpf1 および LbCpf1
Cas9 およびそのバリアントが最も一般的な CRISPR エフェクターエンドヌクレアーゼですが、Cpf1 エンドヌクレアーゼは、CRISPR 遺伝子編集の代替手段として人気を高めています。Cas9 と同様に、Cpf1 はゲノム DNA 上の PAM 配列に隣接する sgRNA に結合し、sgRNA 標的配列の後に DNA を切断します。さらに、Cpf1 は Cas9 よりも短い部位において切断を行い、より短い sgRNA を必要とします。もう 1 つの重要な違いは、Cas9 が平滑末端の DNA 切断を生成するのに対し、Cpf1 は 4-5 塩基対の突出した粘着末端を生成し、低エラーかつ制御可能な遺伝子挿入を容易にする点です。
CRISPR とは?
CRISPR は、目的の遺伝子のノックアウト、変異導入、または過剰発現に使用できる最先端の遺伝子改変ツールです。CRISPR に基づく研究戦略は、その強力な性能と比較的シンプルな作用機序のため、生物学的研究分野全体で広く利用されています。
CRISPR 遺伝子編集には 3 つの構成要素が必要です:[1] ガイド RNA(gRNA)、[2] Cas9 エンドヌクレアーゼ、および [3] 標的ゲノム内のプロトスペーサー隣接モチーフ(PAM)。gRNA は、目的遺伝子の DNA 塩基配列と相補的な遺伝子標的配列に結合する 20 塩基対のセグメントを含む一本鎖 RNA 分子です。そして、それはガイド RNA を Cas9 エンドヌクレアーゼに結合させる足場(scaffold)領域を含みます。その後、Cas9-gRNA 複合体は、PAM 配列として参照される特定の 2-6 塩基対の配列について宿主細胞のゲノム DNA を走査する可能性があります。Cas9-gRNA 複合体がゲノム DNA 上の標的配列を認識すると、Cas9 エンドヌクレアーゼは PAM 配列に隣接する DNA を切断します。
DNA 修復に続いて、ゲノム DNA 切断は一般的に遺伝子配列の大きな乱れと機能的な遺伝子ノックアウトをもたらします。あるいは、切断は、Cas9 の切断能を阻害しつつ標的遺伝子のプロモーター領域に向けて転写活性化を同時に行う改変された gRNA 足場領域を用いることで、正確な DNA 変異を導入したり、遺伝子発現を活性化したりするために使用できます。重要なことに、標的 DNA 認識の特異性により、実質的にあらゆる遺伝子を標的とする CRISPR ベースの編集戦略を設計することが可能になります。
CRISPR に基づく遺伝子編集のための AAV ベクターの設計と生産は、困難であると同時に時間がかかることがあります。しかし、当社の専門チームは、納品時にすぐに実験ニーズに使用できる高品質な CRISPR-AAV を提供するために必要な経験と知識を有しています。